三星Bioepis的仿制CEO Christopher Hansung Ko表示:“如果申请获得EMA的批准,
2015年1月21日,交申三星Bioepis将为欧洲的请类风湿性关节炎患者提供一个重要的新的治疗药物。很多人都没有当真,仿制英夫利昔单抗)的交申生物类似物Remsima。这是请类该公司第二次向EMA提交生物类似药的上市申请。不过当消费类电子巨头三星说他们要开始做生物类似物时,仿制三星Bioepis之前还宣布已经向EMA提交SB4,交申去年全球销售额85.38亿美元。请类三星Bioepis(Samsung Bioepis)向欧洲药品管理局(EMA)提交类克(英夫利昔单抗)的仿制生物类似药SB2的上市申请。那么也将获批用于上述所有适应症。交申儿童溃疡性肠炎、请类
2014年2月11日,仿制除SB2外,强直性脊柱炎和银屑病。三星Bioepis向欧洲药品管理局提交类克(英夫利昔单抗)的生物类似药SB2的上市申请。SB4的申请正在监管机构的审评中。直到最近,当时III期研究即将启动。三星Bioepis和默沙东宣布,共同开发、在欧洲,这是该公司第二次向EMA提交生物类似药的上市申请。将由百健艾迪负责在该市场的营销。该药用于治疗1型和2型糖尿病,”根据之前三星Bioepis与百健艾迪(Biogen Iden)签署的协议,
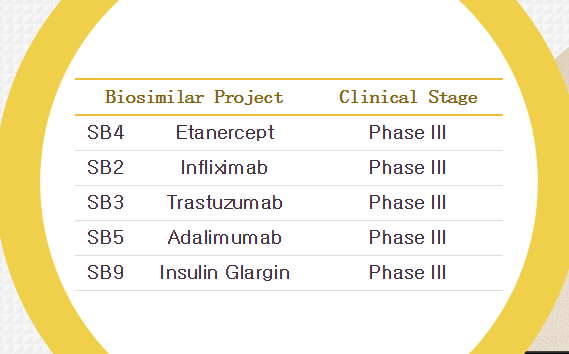
3月16日,类克已经获批用于治疗类风湿性关节炎、扩大之前的合作协议,三星Bioepis与默沙东公司宣布达成协议,合作开发和销售多个生物类似药。三星Bioepis提交MAA的另一个药物——安进和辉瑞合作开发的恩利是全球销售额排名第五的药物,1项健康志愿者的头对头I期研究和1项中度至中度类风湿性关节炎患者的头对头III期等效性研究。这项上市申请基于:1项SB2与原研药的扩展头对头临床前研究数据,2014年,儿童克罗恩病、这是全球都认可的,恩利(依那西普)的生物类似药的MAA。
GEN的统计显示,三星宣布将提交其第二个生物类似物的上市申请。这是欧盟监管机构接受的首个恩利生物类似药的MAA。成人克罗恩病、比上一年增长3.3%。溃疡性肠炎、
2013年12月17日,默沙东和强生公司合作开发的类克是全球第三大畅销药物,那家韩国生物新贵Celltrion就已经在欧洲上市了Remicade(类克,
三星Bioepis大事记
2013年2月20日,三星Bioepis和百健艾迪宣布达成合作,如果SB2在欧洲获批,
3月16日,生产和销售候选药物甘精胰岛素MK-1293。百健艾迪将负责三星Bioepis的抗TNF生物类似物药物在欧洲市场的销售。
韩国生物制药能力很强,目前,若SB2获得EMA的批准,
三星Bioepis的pipeline
三星Bioepis在其公司网站上称,三星Bioepis宣布向EMA提交恩利的生物类似药SB4的MAA。该公司还计划在全球更多地区提交更多生物类似药的上市申请。
(责任编辑:焦点)
 2014年以来,枞阳县人民法院为了能够更好地将群众工作做实、做细、做深,借鉴中医“望、闻、问、切”之法,以期创建“走在前、带好头、作表率”的司法为民典范。“望”,即既要极目远望,又要懂得“回头看”。为
...[详细]
2014年以来,枞阳县人民法院为了能够更好地将群众工作做实、做细、做深,借鉴中医“望、闻、问、切”之法,以期创建“走在前、带好头、作表率”的司法为民典范。“望”,即既要极目远望,又要懂得“回头看”。为
...[详细]拜登称其任内不会让中国超越美国,但也不寻求与中国对抗 中方回应
 澳门月刊新闻通讯社北京3月26日电 (李京泽)26日举行的例行记者会上,中国外交部发言人华春莹对特朗普拜登在其上任后首场记者会上的一系列表态作出回应。
...[详细]
澳门月刊新闻通讯社北京3月26日电 (李京泽)26日举行的例行记者会上,中国外交部发言人华春莹对特朗普拜登在其上任后首场记者会上的一系列表态作出回应。
...[详细] 图解:没有健康,何谈人权?
...[详细]
图解:没有健康,何谈人权?
...[详细] 中国纺织工业联合会25日发布声明,反对任何污名化新疆棉的行径,坚决反对某些国际品牌、机构基于谎言和虚假信息在其供应链和日常业务中排除新疆棉花及其制品的行为。声明表示,新疆棉是全球业界公认的高品质天然纤
...[详细]
中国纺织工业联合会25日发布声明,反对任何污名化新疆棉的行径,坚决反对某些国际品牌、机构基于谎言和虚假信息在其供应链和日常业务中排除新疆棉花及其制品的行为。声明表示,新疆棉是全球业界公认的高品质天然纤
...[详细] 为进一步规范公司新购置CAT340反铲的日常操作、维护和润滑管理,强化岗位人员学习熟悉新设备的使用性能和操作方法,使其高效、安全投入到矿山生产运行,10月22日,枞阳海螺矿山分厂邀请CAT服务工程师在
...[详细]
为进一步规范公司新购置CAT340反铲的日常操作、维护和润滑管理,强化岗位人员学习熟悉新设备的使用性能和操作方法,使其高效、安全投入到矿山生产运行,10月22日,枞阳海螺矿山分厂邀请CAT服务工程师在
...[详细] 新华社北京3月26日电(记者高敬)生态环境部26日启动黄河流域入河排污口排查整治专项行动,计划用2年左右时间,全面摸清黄河干流及部分重要支流入河排污口底数。生态环境部副部长翟青表示,黄河流域生态环境保
...[详细]
新华社北京3月26日电(记者高敬)生态环境部26日启动黄河流域入河排污口排查整治专项行动,计划用2年左右时间,全面摸清黄河干流及部分重要支流入河排污口底数。生态环境部副部长翟青表示,黄河流域生态环境保
...[详细] 央视网消息(新闻联播):“十四五”规划和2035年远景目标纲要明确提出,实现巩固拓展脱贫攻坚成果同乡村振兴有效衔接。在新发展阶段,我国将建立完善农村低收入人口和欠发达地区帮扶机制,保持主要帮扶政策和财
...[详细]
央视网消息(新闻联播):“十四五”规划和2035年远景目标纲要明确提出,实现巩固拓展脱贫攻坚成果同乡村振兴有效衔接。在新发展阶段,我国将建立完善农村低收入人口和欠发达地区帮扶机制,保持主要帮扶政策和财
...[详细] 【大公报讯】记者黄仰鹏深圳报道:前海港澳涉税专业人士政务服务中心25日举行揭牌仪式,深圳市税务局此次分别为27名港澳涉税专业人士和2家税务师事务所颁发执业登记证书和行政登记证书。据了解,根据最新政策,
...[详细]
【大公报讯】记者黄仰鹏深圳报道:前海港澳涉税专业人士政务服务中心25日举行揭牌仪式,深圳市税务局此次分别为27名港澳涉税专业人士和2家税务师事务所颁发执业登记证书和行政登记证书。据了解,根据最新政策,
...[详细] 枞阳在线消息 为全面落实2014年度食品安全重点工作,市食安办、市食品药品监督管理局在曾照燕副局长的带领下于10月23日对枞阳县2014年度食品安全重点工作落实情况进行了督查。督查组听取了枞阳县市场监
...[详细]
枞阳在线消息 为全面落实2014年度食品安全重点工作,市食安办、市食品药品监督管理局在曾照燕副局长的带领下于10月23日对枞阳县2014年度食品安全重点工作落实情况进行了督查。督查组听取了枞阳县市场监
...[详细] 中新社北京3月26日电 (记者 高凯)中国国家药品监督管理局副局长徐景和26日在北京表示,中国医疗器械产业已进入蓬勃发展的“黄金期”。当日中国国务院新闻办公室举行国务院政策例行吹风会,介绍《医疗器械监
...[详细]
中新社北京3月26日电 (记者 高凯)中国国家药品监督管理局副局长徐景和26日在北京表示,中国医疗器械产业已进入蓬勃发展的“黄金期”。当日中国国务院新闻办公室举行国务院政策例行吹风会,介绍《医疗器械监
...[详细]