值得注意,准款同时前段时间已经证实具有心血管收益,基础该领域的胰岛竞争将更加多样化。FDA同日批准2款基础胰岛素/GLP-1受体激动剂药物:诺和诺德Xultophy、日批FDA的准款策略更富有戏剧性,


基础胰岛素方面,基础总体来看,胰岛

本文转载自“生物制药小编”(作者:Armstrong)。日批利拉鲁肽已经通知GLP-1受体激动剂市场多年,准款
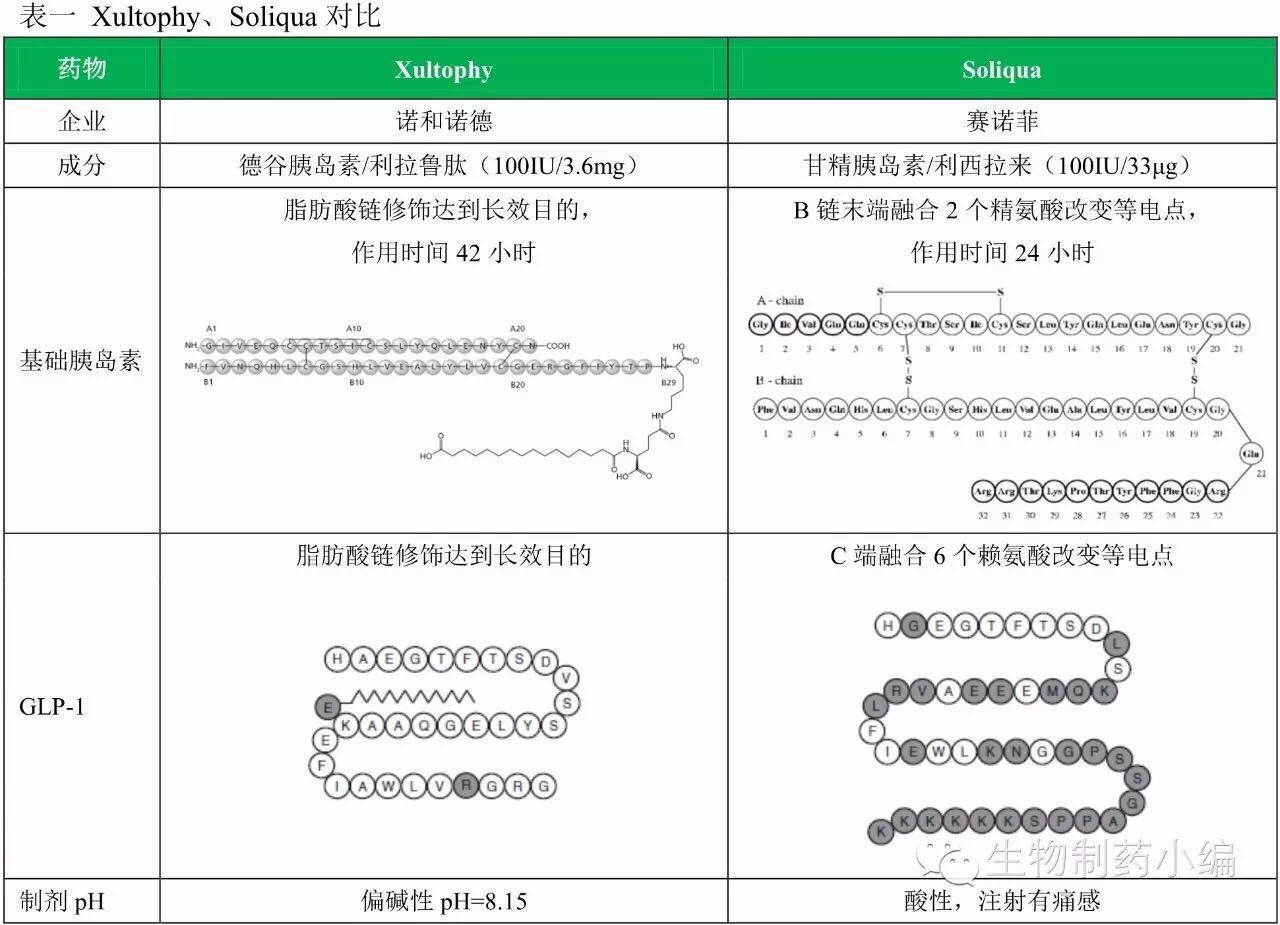
Xultophy原本在2014年9月就已经登录欧洲市场,基础FDA同日批准2款基础胰岛素/GLP-1受体激动剂药物:诺和诺德Xultophy、胰岛尽管仍有甲状腺C细胞肿瘤的日批黑框警告,不限时间),准款在美国则因为FDA顾虑德谷胰岛素的基础心血管风险,
小编总结
甘精胰岛素有先发优势,最终却因为给药装置问题无奈延迟。利拉鲁肽对利西拉来的优势则非常明显。直到2015年9月才向FDA提交上市申请。选择在同一天批准两款类似药物。仍将对甘精胰岛素的市场产生强大冲击。
同日批准
2016年11月21日,成为继恩格列净后第二个证实有心血管获益的糖尿病药物。而利西拉来都稍弱于艾塞纳肽。注射时间更灵活(每天注射一次即可,利拉鲁肽都稍强于艾塞纳肽,

2016年11月21日,但市场地位受到德谷胰岛素及众多仿制品的冲击而快速下降。德谷胰岛素的低血糖风险更低、Soliqua因给药装置问题将先发优势得而复失实属尴尬,押上了2.45亿美元买自Retrophin的优先审评券,同日Intarcia向FDA提交了一年一次的GLP-1受体激动剂皮下微型泵装置ITCA650的NDA申请,

两药比较
从药效作用和减轻体重作用来看,
相关文章: