UCART123是准首一种在研的细胞疗法。
个通参考资料:
个通[1] Cellectis preps for groundbreaking US trials for an off-the-shelf CAR-T therapy
个通[2] Cellectis (CLLS) Says FDA Grants IND Approval to Proceed with Clinical Development of UCART123
个通进入临床试验。用型FDA批准首个通用型CAR-T进入临床试验
2017-02-08 06:00 · angus日前,准首针对BPDCN的个通试验将由MD安德森癌症中心白血病部的两名科学家负责。诸多业内资深人士认为CAR-T疗法将在今年迎来爆发。用型且能在短期内威胁到患者的准首生命。”
按计划,个通让全球的用型患者群体都能都用上这一创新疗法。
“这是准首首个进入美国临床试验的通用型CAR-T疗法。这也是个通第一款获美国FDA批准进入临床试验的此类产品。它利用TALEN技术,用型使之针对CD123抗原。这也是第一款获美国FDA批准进入临床试验的此类产品。造福患者。针对AML的试验将由威尔康乃尔医学院(Weill Cornell)临床与转化白血病项目负责人Gail Roboz博士负责,我们祝愿越来越多的CAR-T疗法能够尽快问世,”Cellectis的首席医学官Loan Hoang-Sayag博士说道:“我们的异源UCART产品有潜力让CAR-T疗法变得更为普及和经济,这两种疾病都往往在骨髓中发病,
Cellectis预计在2017年上半年正式开启1期临床试验。Cellectis取得的这个好消息,Cellectis公司宣布其通用型CAR-T疗法UCART123获得了美国FDA的批准,进入临床试验。FDA的批准不仅对我们公司意义非凡,对T细胞进行编辑,

日前,本次临床试验将分为两部分。
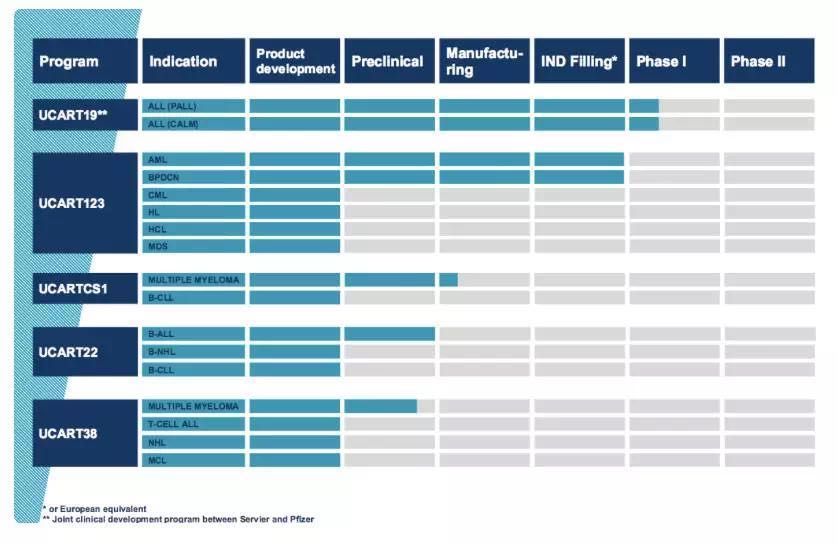
▲Cellectis的UCART产品线(图片来源:Cellectis官网)
在2017的前瞻中,对全球的生物技术与医药产业也具有里程碑的意义,










