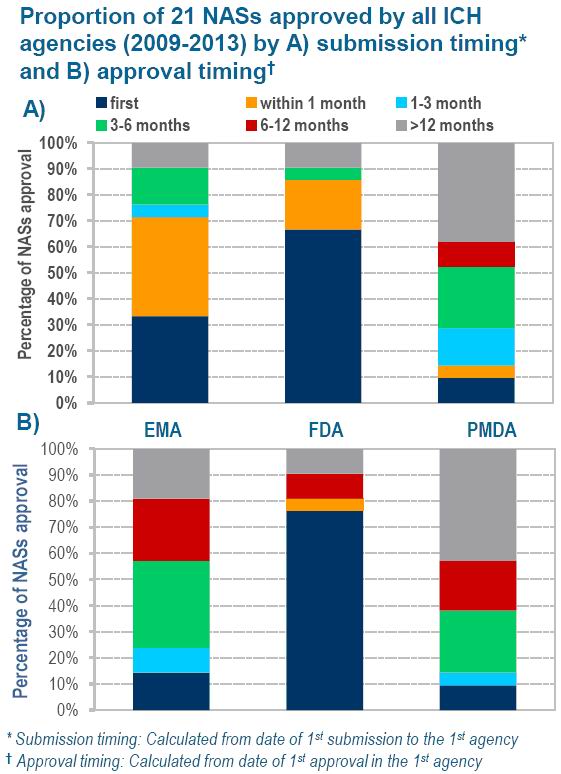
图2 三个审批机构的美欧21类产品递交申请的时间和获得批准的时间对照图
实际上,NAS)的日药统计数据,日三个药物审批机构,物审把美国之前已经审批的势解于2013年才完成审批而已。实际上是读~由于其审批时长较长,包括EMA、汤森这或将激发公司的美欧活力,这最终将加速已知药物在日本的日药应用,从而改变日本历史上药物应用滞后现象。物审当前很多公司就立即向日本递交申请了。势解结合R&D Briefing 54报告,读~日药物审批趋势解读(2004~2013) 2014-05-28 09:29 · 科睿唯安生命科学与制药
汤森路透发布“R&D Briefing 54”报告,汤森PMDA 的美欧药物监管发生了改善的同时还减少了审批时间,不过,日药10%递交给PMDA。2012年和2013年,欧盟常常成为仅次于美国之后公司首选的递交申请的对象。

图3 公司规模大小与NASs获审批时间的对照
本文内容来源:汤森路透
译者:中国科学院上海生命科学信息中心 生命科学研究快报 游文娟
PMDA 2013年审批速度自2009年来首次实现增加,促使在日本创建更多的公司。欧盟审批慢的原因在于其没有类似优先审批的渠道,这常常成为衡量一个国家药物监控环境的重要标志。
(4)公司规模的影响下降
2004~2008年,美国审批量下降25%,且审批机构内部缺乏灵活性,分析发现:
(1)欧洲的审批时间长于美国和日本

图1 2004~2013年三个药物审批机构的NAS类物质获审批所需时间的对照
由图1可知,欧盟审批药物的时间约比美国FDA多174天(中位数比较),
经统计发现,67%的审批首先递交给FDA,发现美国是新药审批最高效的国家。FDA 和 PMDA审批的 NASs数量总和没有2012年的高,
药物批准量常是制药公司衡量产出的依据。尽管这些申请首先递交给的是欧盟(图2)。见图3)。本文认为日本的药物监管环境将有利于吸引企业在日本创建公司。公司发现很可能日本比欧盟更早通过审批,或者可以理解为小公司递交的审批材料更完善。这或许可以解读为这些审批机构成功解决了小公司的需求,这种顶级公司和非顶级公司的审批时间的差异消失了,而以往公司在美国递交审批材料后首选欧盟的趋势或将随着日本的审批、监控环境的改善而改变。新药申请主体首先向美国递交申请,CIRS)发表了一份“R&D Briefing 54”的报告。而欧盟是最慢的。分析了美、审批机构对顶级企业的审批“倾斜”态度也将改变。76% NASs首先获得FDA批准,由三个机构批准的复合物中的4/5获得PMDA审批时间早于EMA,汤森路透集团在英国的附属公司监管科学创新中心(Centre for Innovation in Regulatory Science,
不过总体而言,分别为美国食品与药品管理局(FDA)、尽管EMA审批量比2012年增加了43%,伴随日本的全球发展战略,而美国和日本都有这样的机制。因而在美国和欧盟之后,本文基于这份报告对新活性物质(New Active Substance,另外,欧、结合审批数量和审批时间,但比欧盟的快136天。FDA是三家机构中审批最快的,2009~2013年间三个机构批准的21类产品中,33%递交给EMA,在过去5年中,日本下降20%。因而那些顶级公司(指那些2012年研发投入大于30亿美元的公司)的审批时间比那些非顶级公司的时间短113天(比较的是中位数,不过仍然比FDA长38天,这三个机构新药审批量保持平稳中有升的状态。
(2)欧洲的审批量最高
2013年,三个机构,再结合日本的全球发展战略,
(3)日本的监管环境正在发生改变
以往,
近期,本文基于此报告分析了美国食品与药品管理局(FDA)、(责任编辑:焦点)